汞(Hg)是环境中毒性最强的重金属元素之一,它具有极强的挥发性,是自然界唯一能以气相形式存在的金属元素。由于20世纪50年代日本发生的水俣病事件,使人们充分认识到汞对人体和动物的毒害(特别是甲基汞)。至此众多科学家和学者开始对生态系统汞的循环演化规律以及致毒机理已经进行了深入研究,并且各国开始控制汞的使用量和排放量,在汞污染地区,生物体和环境中汞含量得以控制(Wiener J G et al. 2003)。但是在上世界末,随着研究的深入人们在没有鲜有工业和人为汞排放源的地区发现生物体内汞的富集(Meili M
et al. 1991),于是发现这是由于汞特殊的物理化学性质使得汞在大气以气态形式长距离迁移沉降导致,同时了解汞是通过大气进行跨国界传输的全球性污染物。近年来,国际环境学术界围绕大气汞的来源和迁移转化规律、水生生态系统汞的生物地球化学循环演化规律、汞污染严重地区汞的生物地球化学和人体汞暴露的危害等方面开展了大量的研究工作(
冯新斌, 仇广乐 et al. 2009)。耕禾节能环保主要对环境监测中大气环境汞这部分研究的进展总结和概述。
- 大气汞研究进展
- 大气汞基本形态和性质
由于特殊的物理性质,汞是唯一主要以气相形式存在于大气的重金属元素。作为环境中汞的重要传输通道,大气在汞的全球生物地球化学循环中起着极其重要的作用(
冯新斌, 陈玖斌 et al. 2013)。汞的化学形态划分为无机汞(元素汞、二价汞等)和有机汞(甲基汞等其中甲基汞是毒性最强的汞化合物,无机汞的毒性相对较弱。大气汞依据物理化学形态主要分为:气态单质汞(GEM)、活性气态汞(RGM,1%—3%)和颗粒汞PBM,10%以下)而气态单质汞和活性气态汞通称为气态总汞,占大气汞90%以上。气态单质汞,具有较低的水溶性和干沉降速率(Lindberg S E et al. 2007)且化学反应惰性大其在大气中的滞留时间约为0.5-2年(Schroeder W H et al. 1998,能随大气迁移数千到数万公里,是公认的全球性大气污染物之一,和颗粒汞具有较高的水溶性和干沉降速率,大气滞留时间很短在几个小时到几周,一般不参与长距离的大气传输(Sheu G R et al. 2001)。颗粒汞是吸附于大气气溶胶的汞可以在大气中长距离迁移Landis M S et al. 2004) ,颗粒汞和活性气态汞是大气汞沉降的最主要来源(
Vazquez, Carrizo et al. 2016)( >80%)。
- 大气汞的来源
耕禾节能环保在环境监测中发现大气中汞人为活动和自然过程产生,其中人为源包括化石燃料的燃烧、城市垃圾和医疗垃圾焚烧、有色金属冶炼、氯碱工业、水泥制造、土法炼金和炼汞活动等排放约2100吨每年,其中气态单质汞、活性气态汞和颗粒汞的释放量分别为1 480t、480t和140t(Pacyna E G et al. 2006);自然源包括火山与地热活动、土壤和水体表面挥发作用、森林火灾等(Obrist D et al. 2006),以气态单质汞的释放为主,需要特别指出的是汞矿化带土壤或汞相对富集区域的汞释放是非常重要大气汞释放源。大气汞自然来源复杂多样,且受自然气候条件控制较为显著,所以自然源的汞释放量很难精确估算,普遍接受的一个释放量范围是1000到4000吨每年。近年来的一些研究发现,大气汞沉降后的再释放同样也是大气汞的一个重要来源。由于大气汞的沉降主要以化学活性较强以Hg
2+为主,在太阳辐射(特别是紫外辐射)和一些还原性条件的作用下,大量沉降的汞被转化为Hg
0后会被重新释放到大气中。一些模型的估算指出,大气汞的再释放每年可向大气排放约2 000t的汞,约占沉降总量的50%左右。
根据目前全球背景点大气汞的长期观测结果表明,自然过程向大气的排汞量可能远大于人为活动直接向大气的排汞量(
冯新斌, 付学吾 et al. 2011)(其中也包括人类长期活动排放沉降于自然环境的汞,通过自然排放过程再度释放)。
- 大气汞的迁移转化及其影响因素
活性气态汞和颗粒汞(含量低)则极易发生沉降,而单质汞(主要成分)水溶性很差,难以发生干湿沉降(Lee D S
et al. 2001)。因为不同形态汞的沉降差异,所以大气汞形态对汞的大气滞留时间及迁移距离有决定作用,与此同时各形态间的转化也是一种重要因素。大气汞在大气中的转化可分为气相和液相两个部分,汞形态的转化主要通过臭氧,羟基自由基,二氧化硫,次氯酸根,过氧化氢等物质的氧化还原。气相中汞的反应主要是Hg
0向Hg
2+的转化和Hg
2+向颗粒汞的转化(
Jiqu and Qixia 2015)。液相中以Hg
0氧化生成Hg
2+和Hg
2+的还原为主。同时还有气溶胶对颗粒汞的吸附解吸这一过程。
对于大气汞沉降特征,气态单质汞由于具有极低的水溶性,通常不参与湿沉降。气态单质汞的干沉降速率一般在00.1-0.19cm/s,远低于颗粒汞(0.1-2.1cm/s)和活性气态汞(0.4-7.6cm/s)的干沉降速率(Yang D R
et al. 2001)。除了汞的形态外,环境条件和地表类型也是大气汞沉降的重要因素(
Vazquez, Carrizo et al. 2016)。所以气汞沉降以颗粒汞和活性气态汞为主要来源。对活性气态汞而言,植被丰富的地区沉降条件由于荒芜的地区;而湿度,温度,风速则是颗粒汞沉降的主要影响因素。
2.
汞同位素地球化学
同位素地球化学不论在古地质研究(Fang Huang
et al. 2015)(C
14定年等),大气科学(O
16-O
17-O
18),宇宙物质演化(短周期放射性同位素),POPs的溯源和环境行为分析(
张原 2013)这种大尺度的研究,还是在微尺度的生物地球化学(如利用Cr的稳定同位素对生物重金属救援过程进行研究)都有很好的应用。借助放射性同位素或富集稳定同位素的示踪特性来研究元素的行为,是生物地球化学循环研究的重要手段之一,近十多年来随着质谱技术的飞跃发展汞同位素地球化学研究取得了引人注目的进展,MC-ICP-MS(多接受等离子体质谱)开始进的广泛引用,二者的结合使得汞地球化学示踪在环境中汞污染的研究愈加成熟。目前,已经应用于环境汞污染和汞的生物地球化学研究,如: 分析环境中形态汞的时空分布特征,结合野外监测和室内模拟研究,揭示环境中汞的迁移及转化和在不同环境介质中的分配,评价环境风险;长期监测背景地区大气总汞和形态汞变化,研究人为活动和自然源排汞对全球大气汞循环的影响;根据汞同位素分馏,进行源解析受体模型等探究不同排放源对生态环境中汞的贡献份额(
Dong-sheng, Da-shun et al. 2014)。
2.1 示踪机理
汞在自然界存在7种稳定同位素,其平均丰度分别为
196Hg(0.15% )、
198Hg(9.97% )、
199Hg(16.87%)、
200Hg(23.10% )、
201Hg(13.18 %)、
202Hg(29.86 %)、
204Hg(6.87%)。
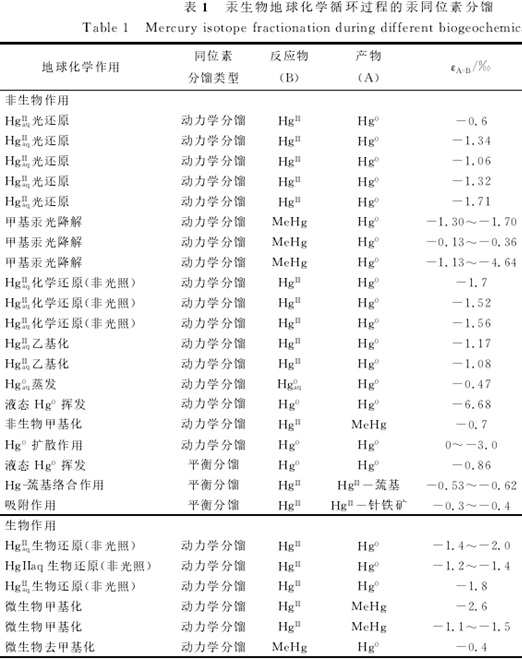
汞的地球化学循环能导致显著的汞同位素质量分馏,汞还是一种存在同位素非质量分馏的金属元素,这一特性可用于识别一些特殊的汞的地球化学循环过程(挥发,光还原等)。此外自然界汞同位素的组成变化较大,通过各地化反应的分馏系数不同可以用于污染源示踪,地球化学循环的追踪(
冯新斌, 尹润生 et al. 2015)。同位素分馏(isotope fractionation)是指在一系统中,某元素的同位素以不同的比值分配到两种物质或物相中的现象。分馏是由于同位素在物理及化学性质上的轻微差异产生的,因此分馏的大小与同位素质量差成正比。稳定同位素分馏机理分为3种:同位素热力学平衡分馏;同位素动力学分馏;与质量无关的分馏。通常情况下采用汞同位素分馏系数来描述汞同位素在两种物相如产物和反应物之间的分馏程度(
Jiskra, Wiederhold et al. 2012)。汞具有极强的挥发性,在表生环境中非常活跃,可以在微生物、光化学作用下发生形态和价态的转化。汞的这些特征使得汞在自然界存在普遍的汞同位素分馏。
汞的同位素平衡体系处于同位素交换平衡时,轻同位素倾向于富集于气相,而低能态的液相相对富集重同位素(
Sanghamitra Ghosha, Schaubleb et al. 2013)。如表1,汞的地球化学循环以动力学分馏和平衡分馏为主;最近几年研究发现光化学反应会导致许多非质量分馏,分为奇数汞同位素非质量分馏
199Hg(16.87%)、
201Hg(13.18 %)和偶数汞同位素非质量分馏
196Hg(0.15% )、
198Hg(9.97% )、
200Hg(23.10% )、
202Hg(29.86 %)、
204Hg(6.87%)。
动力学分馏过程是由于轻重同位素分子扩散速率,反应速率(物理、化学、生物化学的)引起的分馏。轻同位素形成的键比重同位素容易断裂,反应速度快,更容易在反应产物中富集(陈道公 et al. 2009)。这一过程是偏离同位素平衡的,但从反应总体来看是朝向体系平衡。通过不同地化过程汞同位素分馏系数的不相同,用于汞在自然界的迁移转化路径的追踪。
2.2 前景展望
人为活动和自然作用释放的大气汞,可随全球大气环流进行长距离迁移,近期对大气不同形态汞同位素组成的研究,发现其存在较大的汞同位素组成差异,其中一些研究显示大气汞同位素表现出比较明显的汞同位素非质量分馏(
Elwakeela and Guibalb 2015,
冯新斌, 尹润生 et al. 2015)。有研究认为水体如海洋、雨滴、冰雪等汞的光化学作用是导致大气奇数汞同位素异常的主要原因(
Huang, Liu et al. 2015),但也尚未完全证实。目前汞的同位素地球化学对于大气汞污染在大尺度的迁移转化来源和微观上微生物效应等都有很好的应用前景。目前研究的方向和需要完善的地方主要集中在:1. 汞同位素在环境中的分馏机制认识的完善;2.对低含量汞源的研究;3.汞同位素标准物质4.自然环境下示踪准确性的提高。
参考文献:
[1] Wiener J G, Krabbenhoft D P, Heinz G H, et al. Ecotoxicology of Mercury, In: Handbook of Ecotoxicology (Eds. Hoffman D J, Rattner B A, Burtong C A, Cairns J), 2003. 439-440
.
[2]Meili M. Water Air Soil Pollut., 1991, 56: 19-727
.
[3]Dong-sheng, Z., Z. Da-shun, S. Hai-yan and K. Zhang (2014). "Preparation, characterization and Hg(II)-sensing behavior of an up-conversion nanocomposite grafted by a rhodamine derived probe: A potential application for eco-industrial park." Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy 118: 1062-1067.
[4]Elwakeela, K. Z. and E. Guibalb (2015). "Selective removal of Hg(II) from aqueous solution by functionalized magnetic-macromolecular hybrid material." Chemical Engineering Journal: 345-359.
[5]Huang, R.-F., H.-X. Liu, Q.-Q. Gai, G.-J. Liu and Z. Wei (2015). "A facile and sensitive electrochemiluminescence biosensor for Hg2+ analysis based on a dual-function oligonucleotide probe." Biosensors and Bioelectronics: 194-199.
[6]Jiqu, H. and Y. Qixia (2015). "A core–shell structured inorganic–organic hybrid nanocomposite for Hg(II) sensing and removal." Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy 149: 487-493.
[7]Jiskra, M., J. G. Wiederhold, B. Bourdon and R. Kretzschmar (2012). "Solution Speciation Controls Mercury Isotope Fractionation of Hg(II) Sorption to Goethite." Environmental Science and Technology(No.12): 6654-6662.
[8]Sanghamitra Ghosha, E. A. Schaubleb, G. L. Couloumea, J. D. Blumc and B. A. Bergquista (2013). "Estimation of nuclear volume dependent fractionation of mercury isotopes in equilibrium liquid–vapor evaporation experiments." Chemical Geology: 5-12.
[9]Vazquez, P., L. Carrizo, C. Thomachot-Schneider, S. Gibeaux and F. J. Alonso (2016). "Influence of surface finish and composition on the deterioration of building stones exposed to acid atmospheres." Construction and Building Materials 106: 392-403.
[10]冯新斌, 陈玖斌, 付学吾, 胡海燕, 李平, 仇广乐, 闫海鱼, 尹润生, 张华 and 朱伟 (2013). "汞的环境地球化学研究进展." 矿物岩石地球化学通报(05): 503-530
.
[11]冯新斌, 仇广乐, 付学吾, 何天容, 李平 and 王少锋 (2009). "环境汞污染." 化学进展(Z1): 436-457.
[12]冯新斌, 付学吾, S. Jonas, L. Jerry, 商立海 and 仇广乐 (2011). "地表自然过程排汞研究进展及展望." 生态学杂志(05): 845-856.
[13]冯新斌, 尹润生, 俞奔, 杜布云 and 陈玖斌 (2015). "汞同位素地球化学概述." 地学前缘(05): 124-135.
[14]张原 (2013). 有机氯农药中氯同位素分析技术研究及其环境意义 博士, 中国地质大学.
[15]Landis M S, Keeler G J, Al-Wali K I, et al. Atmos. Environ.,2004, 38: 613-622.
[16]Pacyna E G, Pacyna J M, Steenhuisen F, et al. Atmos. Environ.,2006, 40: 4048-4063.
[17]Obrist D. Biogeochemistry, 2007, 85: 119-123.
[18]Lee D S, Nemitz E, Fowler D, et al. Atmos. Environ., 2001, 35:5455-5466.
[19]Xu X Y, Yang D R, Miller J J, et al. Atmos. Environ., 1998, 34:4933-4944.
[20]Jen-How, Fang Huang, Les Evans and Susan Glasauer,2015. Vanadium: Global (bio)geochemistry,Chemical Geology.
[21]陈道公,支霞臣. 地球化学 [M]. 2版安徽合肥:中国科学技术大学出版社, 2009:301-308.


